Како пронаћи бројеве оксидације
Аутор:
Roger Morrison
Датум Стварања:
27 Септембар 2021
Ажурирати Датум:
1 Јули 2024
Садржај
- фазе
- Део 1 Одређивање оксидационих бројева из хемијских правила
- Део 2 Одредите оксидационе бројеве атома који не следе посебна правила
У хемији се појмови "оксидација" и "редукција" односе на реакције у којима један атом (или група атома) губи или добија електроне. Оксидациони бројеви су бројеви додељени атомима (или групама атома) који хемичарима помажу да знају колико електрона се може пренети и да ли реагент под реакцијом оксидације или редукције. Поступак којим се атомизациони број додељује атомима може бити једноставан до веома компликован у зависности од набоја атома и хемијског састава молекула коме припадају. Како би се додатно закомпликовала ствар, неки атоми могу имати више од два оксидациона броја. Срећом, одређивањем оксидационог броја управљају прецизно дефинисана правила која се лако примењују, мада може бити корисно знање из хемије и алгебре.
фазе
Део 1 Одређивање оксидационих бројева из хемијских правила
-

Препознајте да ли је производ на којем радите елемент елемента. Оксидациони број елементарних атома, слободан и не комбинован са другим елементима, увек је 0. То важи за атоме чији је елементарни облик састављен од овог једноставног атома, али и за атоме чији је елементарни облик је дијатомска или полиатомска.- На пример, Ал(С) и Цл2 оба имају оксидациони број 0 јер су у елементарном, некомбинованом облику.
- Имајте на уму да је елементарни облик сумпора, С8или октасенпор, иако неправилан, такође има оксидациони број 0.
-

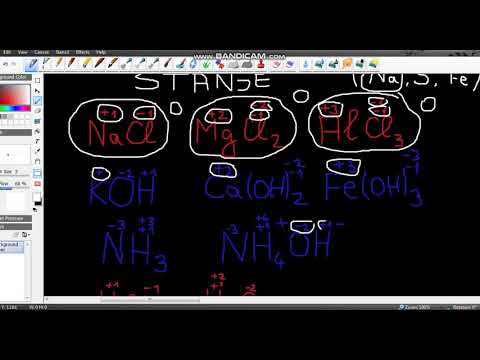
Утврдите да ли је предметни производ у јонизованом облику. Оксидациони број јона једнак је њиховом набоју. То важи за јоне који нису повезани са другим елементима, али и за јоне који су део јонског једињења.- На пример, оксидациони број Цл-јона је -1.
- Цл јон поседује увек оксидациони број -1 када је део НаЦл једињења. Пошто је набој На јона, по дефиницији, +1, знамо да је набој Цл јона -1. Дакле, његов број оксидације је увек -1.
-

За јоне метала може да постоји неколико оксидационих бројева. Многи метални елементи имају више оптерећења. На пример, гвожђе (Фе) може бити у јонизованом облику са набојем од +2 или +3. Набоји металних јона (и стога њихови оксидациони бројеви) могу се одредити као функција наелектрисања осталих атома једињења у којем су део, или пак употребом римских бројева када су информације записане у облику е (као у реченици: "Набој иона гвожђа (ИИИ) је +3").- Узмимо пример једињења које садржи јон алуминијума метала. АлЦл једињење3 има укупни набој 0. Знамо да Цл јони имају наелектрисање -1 и да у једињењу постоје 3, тако да Ал ион мора имати набој +3, тако да укупни набој од свих јона једнак је 0. Оксидациони број Ал је +3.
-

Доделите кисеонику оксидациони број -2 (са изузецима). у већина У неким случајевима, атоми кисеоника имају оксидациони број -2. Међутим, постоје неки изузеци од овог правила:- Кад је кисеоник у елементарном стању (О)2), његов оксидациони број је 0, као што је случај за све елементарне атоме.
- Кад је кисеоник део а пероксид, тада је његов број оксидације -1. Пероксиди су класа једињења која имају једноставну везу кисеоник-кисеоник (или пероксидни анион)2). На пример, у молекули Х2о2 (водоник пероксид), оксидациони број кисеоника (и његово наелектрисање) је -1.
- Када се кисеоник веже на флуор, његов оксидациони број је +2. За више информација прочитајте правила за флуор у овом чланку.
-

Доделите водику оксидациони број +1 (са изузецима). Што се тиче кисеоника, број оксидације водоника подложан је изузетним случајевима. Опћенито, број оксидације водоника је +1 (осим ако је опет у елементарном облику, Х2). Међутим, у случају посебних такозваних хибридних једињења, водоник има оксидациони број -1.- На пример, у молекули Х2О, знамо да водоник има оксидациони број +1 јер кисеоник има наелектрисање -2, а потребна су нам 2 + 1 набоја да би укупни набој једињења био 0.Међутим, у хибридном облику натријум хидроксида, НаХ, водоник има оксидациони број -1, јер На јони имају набој +1; према томе, да би укупни набој једињења био нула, наелектрисање водоника (а тиме и његов број оксидације) мора бити једнак -1.
-

Флуор је увек оксидациони број -1. Као што смо већ напоменули, број оксидација појединих елемената може варирати из више разлога (ово је случај са јонима метала, атомима кисеоника у пероксидима итд.). Међутим, флуор има оксидациони број -1 и то се никада не мења. То је због чињенице да је флуор највише електронегативан елемент - другим речима, елемент који има најмање шансе да да један од својих електрона и који ће највероватније преузети или електрона (е) другог елемента. Због тога се његова оптужба не мења. -

Сматрајте оксидациони број једињења једнаким набоју тог једињења. Збир оксидационих бројева свих атома једињења мора бити једнак набоју овог једињења. На пример, ако неко једињење није набијено, збир оксидационих бројева свих његових атома мора бити једнак 0; ако је једињење ион иона за наелектрисање -1, тада збир оксидационих бројева мора бити -1, и тако даље.- Ово је добар начин да проверите да ли сте добро обавили свој посао - ако збир бројева оксидације вашег једињења није једнак укупном набоју вашег једињења, онда можете бити сигурни да сте погрешили. негде у одређивању ваших оксидационих бројева.
Део 2 Одредите оксидационе бројеве атома који не следе посебна правила
-

Пронађите атоме који немају правила за додељивање оксидационих бројева. За неке атоме не постоји посебно правило за одређивање њиховог броја оксидације. Ако се ваш атом не појави у претходним параграфима и нисте сигурни у његово наелектрисање (ако је на пример део већег једињења и појединачни набој вам није дат), онда можете пронађите број оксидације атома поступком уклањања. Прво ћете одредити оксидациони број сваког другог атома једињења, пре него што одредите број атома који вас занима на основу укупног набоја једињења.- На пример, у На једињењу2ЈЗ4, набој сумпора (С) је непознат - све што можемо рећи је да се његов набој разликује од 0, јер није у свом елементарном облику. Добар је кандидат да применимо ову алгебарску методу за одређивање оксидационог броја.
-

Пронађите бројеве оксидације осталих елемената једињења. Помоћу хемијских правила за одређивање оксидационог броја пронађите бројеве оксидације осталих атома једињења. Обратите пажњу на изузетне случајеве за О, Х атоме, итд.- Следећи правила хемије изложена у претходном одељку, знамо да је то у На једињењу2ЈЗ4 Нани јони имају набој (а самим тим и оксидациони број) од +1, а атоми кисеоника имају оксидациони број -2.
-

За сваки атом помножите њихов број са бројем оксидације. Сада када знамо бројеве оксидације свих наших атома, осим атома који нас занима, морамо узети у обзир да се неки од ових атома могу појавити више од једном у једињењу. Помножите бројчани коефицијент сваког атома (записан у индексу након хемијског симбола атома у једињењу) са његовим бројем оксидације.- У На једињењу2ЈЗ4знамо да постоје 2 атома На и 4 атома О. Тако да морамо помножити +1 (број оксидације На) са 2 да бисмо добили резултат 2, а затим помножили -2 (број оксидација О) са 4 да би се добио резултат -8.
-

Додајте резултате. Додајте резултате својих множења да бисте добили оксидациони број без узети у обзир број оксидације атома који нас занима.- На примеру На2ЈЗ4, било би потребно додати 2 и -8 да бисте добили -6.
-

Израчунајте непознати број оксидације на основу набоја једињења. Сада имате све потребне информације да бисте пронашли оксидациони број који нас занима користећи једноставна алгебарска правила. Успоставите једнаџбу према којој су резултати претходних корака плус непознати број оксидације једнаки укупном набоју једињења. Другим речима: (Збир познатих бројева оксидације) + (непознати број оксидације) = (наелектрисање једињења).- Узимајући пример На2ЈЗ4Ево како то учинити:
- (Збир познатих бројева оксидације) + (непознати оксидациони број) = (једињење набоја)
- -6 + С = 0
- С = 0 + 6
- С = 6. Оксидациони број С једнак је 6 у На-једињењу2ЈЗ4.
- Узимајући пример На2ЈЗ4Ево како то учинити: