Како пронаћи број протона, електрона и неутрона
Аутор:
Roger Morrison
Датум Стварања:
27 Септембар 2021
Ажурирати Датум:
1 Јули 2024

Садржај
- фазе
- Део 1 Израчунајте број протона, електрона и неутрона
- Део 2 Израчунајте број електрона у једном јону
Неутрони, електрони и протони су три главне честице које чине атом. Као што можете претпоставити, протони имају позитиван набој, електрони носе негативан набој, а неутрони су само неутрални честице. Маса електрона је врло мала. Међутим, неутрони и протони имају сличну масу. Да бисте пронашли број протона, електрона и неутрона атома, довољно је консултовати периодну табелу елемената, која се такође назива и Менделејева табела.
фазе
Део 1 Израчунајте број протона, електрона и неутрона
-
Набавите периодичну табелу предмета. Ова табела ће вам помоћи да пронађете број протона, електрона и неутрона у елементу. То је табела која приказује елементе у складу са њиховом атомском структуром. Шифра боја разликује различите елементе. Сваки елемент је идентификован симболом који садржи једно, два или три слова. Табела такође приказује друге информације као што су атомска маса и атомски број сваког елемента.- Ову табелу можете пронаћи претрагом на интернету или у хемијској књизи.
- Код прегледа обично ћете моћи да користите периодичну табелу елемената.
-
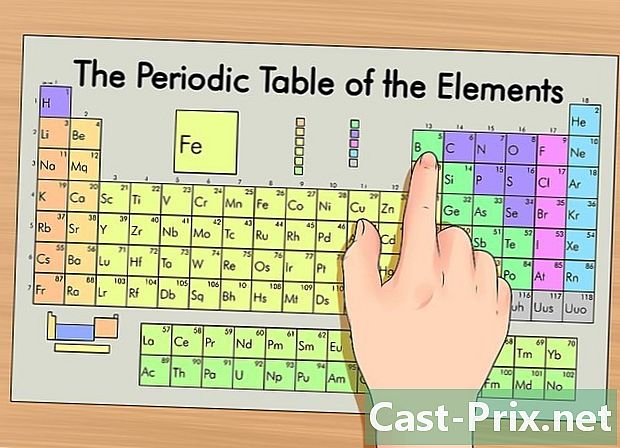
Идентификујте свој елемент у периодичној табели. У табели су елементи груписани према свом атомском броју. Подељени су у три главне групе: метали, неметали и металоиди (полу-метали). Остале групе укључују алкалне метале, халогене и племените гасове.- Лакше је пронаћи елемент у низу користећи његову групу (ступац) или период (ред).
- Ако не знате својства елемента, можете потражити његов симбол.
-
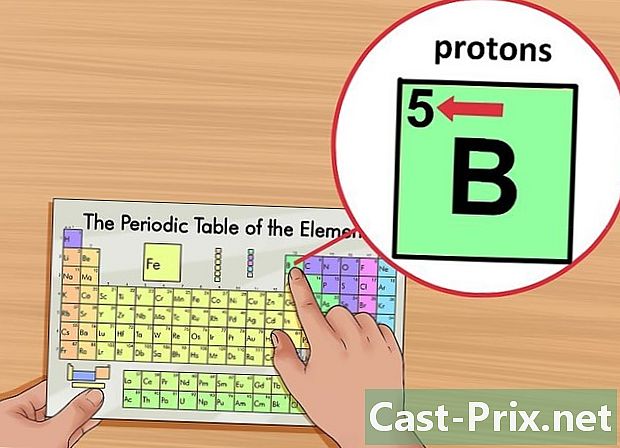
Пронађите атомски број елемента. Овај број је означен у горњем левом углу оквира, изнад симбола елемента. Атомски број вам даје број протона који чине предметни елемент.- На пример, атомски број бора (Б) је 5. Дакле, има 5 протона.
-

Одредите број електрона. Нуклеус атома укључује протоне који су позитивно наелектрисане честице. Електрони су негативно наелектрисане честице. Стога ће број протона и електрона неутралног елемента бити исти.- На пример, бор (Б) има атомски број 5, тако да има 5 протона и 5 електрона.
- Међутим, ако је позитиван или негативан јон, број протона и број електрона ће бити различити. Морате их израчунати. Лево набој означава ситним словима експонент након одговарајућег предмета.
-

Потражите атомску масу елемента. Овај корак ће вам омогућити да пронађете број неутрона. Прво морате да одредите атомску масу или атомску тежину елемента. Овај податак представља просечну масу атома овог елемента. Уписан је под симбол елемента.- Обавезно заокружите атомску масу елемента на најближи цели број. Дакле, бор има атомску масу 10.811, али мораћете да се померите на 11.
-

Направите разлику између атомског броја и атомске масе. Да бисте израчунали број неутрона, морате разликовати атомски број од атомске масе. Не заборавите да већ знате атомски број. Једноставно је идентичан ономе протона.- За бор ћете имати: 11 (атомска маса) - 5 (атомски број) = 6 неутрона
Део 2 Израчунајте број електрона у једном јону
-

Пронађите електрични набој јона. Овај број се приказује експонентом након симбола елемента. Јон је атом са позитивним или негативним набојем услед додавања или супресије електрона. Број протона у атому не варира. Међутим, у јону се мења број електрона.- Пошто један електрон има негативан набој, након уклањања једног или више електрона постаје позитиван. С друге стране, додавање електрона имаће ефекат наелектрисања набоја.
- На пример, оптерећење Н је -3. Са друге стране, вредност Ца је +2.
- Не заборавите да ово израчунавање није неопходно ако симбол елемента не прати експонент.
-

Уклоните набој из атомског броја. Изворно, јон с позитивним набојем је атом који је изгубио електроне. Да бисте пронашли број електрона, морате да одузмете додатне набоје од атомског броја. Ако је лав позитиван, број протона је већи од броја електрона.- На пример, набој Ца је +2. Као резултат тога, изгубио је 2 електрона у поређењу са својим почетним стањем. Атомски број калцијума је једнак 20, па лав има 18 електрона.
-

Додајте набој атомском броју негативних јона. Када је јон негативно наелектрисан, латоме има додатне електроне. Да би се израчунао укупан број електрона, довољно је да се атомском броју дода број додатних набоја. Ако је лав негативан, има мање протона од електрона.- На пример, оптерећење Н је -3. Дакле, он носи још 3 електрона у односу на првобитно стање. Атомски број лазота је 7. Дакле, овај јон има 10 електрона.

